您现在的位置是:首页 > 牙齿美白知识
2023盘点|骨与软组织肿瘤外科治疗进展
皓齿牙科网
2025-01-28【牙齿美白知识】10人已围观
简介在Pubmed和Webofscience中使用“BoneTumor”、“SoftTissueSarcoma”、“Osteosarcoma”、“Chondrosarcoma”、“EwingSarcoma”、“GiantCellTumorofBone”、“OperativeProcedure”、“Sur...
在Pubmed和Webofscience中使用“BoneTumor”、“SoftTissueSarcoma”、“Osteosarcoma”、“Chondrosarcoma”、“EwingSarcoma”、“GiantCellTumorofBone”、“OperativeProcedure”、“SurgicalProcedure”、“SurgicalTreatment”等相关词对2023年发表文献进行筛选,并最终选取JCR1区、2区和部分中文核心期刊进行汇总。我们发现,尽管化疗在骨与软组织肿瘤的治疗中仍占据重要地位,但外科治疗及围手术期管理的作用同样不可忽视。本文将全面介绍2023年骨与软组织肿瘤外科治疗领域的新进展,包括手术技术的进步、原发性及转移性肿瘤的治疗、骨缺损的重建,以及术后抗生素的使用等方面的内容。
骨肿瘤外科治疗目的是安全边界切除肿瘤,同时重建功能。Dieffenbach[2]通过回顾性分析发现,对于经历多次手术负担的晚期Ewing肉瘤和骨肉瘤患者,如需再次手术可能是为了最大限度减轻瘤负荷、重建功能,或处理肿瘤相关的并发症,因此手术抉择需要更加谨慎。
不同部位的骨肿瘤需选择不同的手术方法。约90%肢端骨肉瘤患者接受保肢治疗,且术后应用3D定制假体进行肢体重建也越来越广泛;近年通过导航和计算机辅助设计的截骨导板进行了更精确的骨盆等复杂部位肿瘤切除;对于脊柱原发恶性骨肿瘤多采用全脊椎切除术(TotalEnblocSpondylectomy,TES)[3],脊柱转移瘤治疗理念推荐分离手术联合立体定向放疗综合控制,减压联合固定手术的比例有所增加,而肿瘤切除手术比例有所下降[4,5]。因此我们在进行外科治疗时要全面谨慎。下述文献从手术策略选择、骨肉瘤肺转移、复发性骨巨细胞瘤等多个方面总结外科治疗相关研究及诊疗新思路。
一、诊疗理念和策略1、术前规划及治疗策略
由于骨肿瘤形态各异,为了保留更多肢体功能并确保肿瘤完全切除,Lee[6]通过使用订制化3D打印截骨导板(3D-printed,patient-specificresectionguides,3DP-PSRGs)进行术前规划,以实现更准确的肿瘤切除。该研究队列结果显示患者肢体功能良好,但截骨差异仍需手术前后影像学资料全面评估。
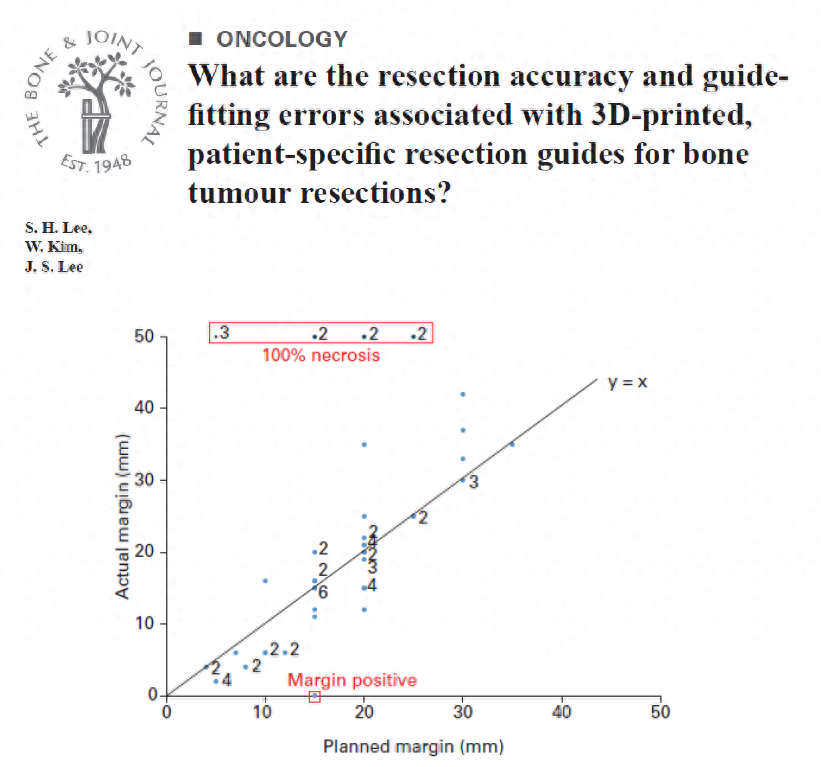
图1研究结果显示实际切除边界和计划边界的相关性,仍存在截骨差异[6]
目前NCCN骨肿瘤指南(2023版)认为病理性骨折是四肢恶性骨肿瘤患者的保肢手术禁忌证。然而Gonzalez[7]通过回顾性分析发现出现病理性骨折的患者在接受保肢或截肢手术后,局部复发率类似。这表明病理性骨折作为保肢禁忌证仍值得商榷。此外,既往研究显示肩胛骨原发性骨肿瘤术后功能结果取决于盂肱关节和三角肌的保留情况,Broida[8]研究显示高级别恶性肿瘤和完全切除肩胛骨是生存率低的独立危险因素,切缘阳性与局部复发显著相关,保留盂肱关节与肩胛冈是改善肢体功能的关键,且保留后者更为重要。
2023年CSCO骨与软组织肿瘤指南相较于此前版本,新增骨盆骨肉瘤的外科治疗分层选择(详见下表)。
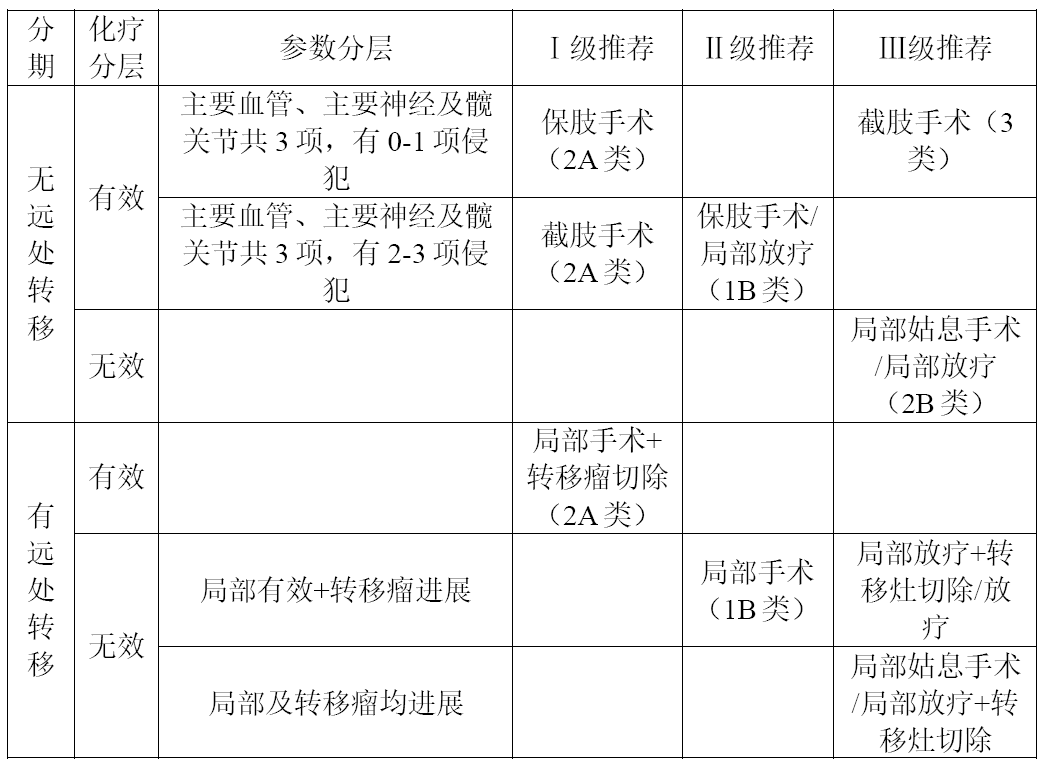
表1骨盆骨肉瘤的外科治疗策略
2、术中操作实施
目前,单纯的影像学导航技术在指导软组织肿瘤手术中的应用受限,因为它无法适应术中位置变化,进而影响手术的精度、安全性或效果。Herson[9]使用CT、MRI和荧光成像的组合在人体肿瘤模型上进行肿瘤定位,结果显示与单独的导航模式相比,联合导航模式的定位准确性更高。证明荧光成像联合放射学导航提高了手术操作的精确度和准确性。
目前已有研究团队将术中荧光引导技术应用于骨与软组织肿瘤领域。Wang[10]在手术期间对34例骨和软组织肿瘤患者进行了吲哚菁绿(ICG)荧光成像,在手术前一天的60分钟内以2mg/kg的剂量静脉注入ICG。随后分析每个肿瘤的染色率,并在肿瘤切除后,对有荧光残留的部位进行活检。总体肿瘤染色率为88%,骨肉瘤特异性染色率为90%,骨巨细胞瘤特异性染色率为92%。对于恶性肿瘤,总染色率为94%,而对于良性肿瘤,染色率为82%。结果证明这种成像技术在识别残留肿瘤组织方面具有潜在临床应用价值。
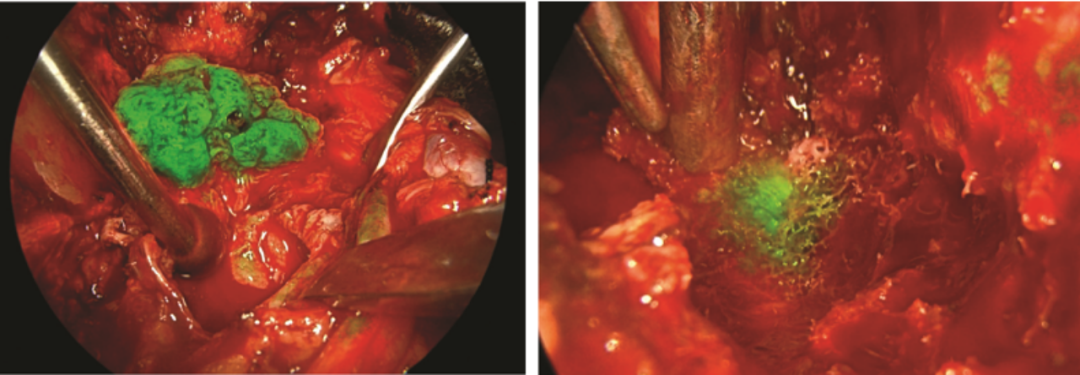
图2骨和软组织肿瘤及残余术中成像[10]
骨科机器人因其在精准定位与机械臂稳定性方面的优势也被逐渐应用于骨肿瘤辅助切除。国内多个研究团队[11,12]通过比较接受骨科机器人辅助切除和行传统开放手术的骨样骨瘤等良性骨肿瘤患者,显示机器人辅助切除组早期疗效较好、术中病灶定位时间更短、并发症更低。恶性骨肿瘤侵袭性更强,手术安全边界要求更高,异型切除曲面更复杂,因此恶性骨肿瘤机器人辅助手术仍在不断完善探索中。
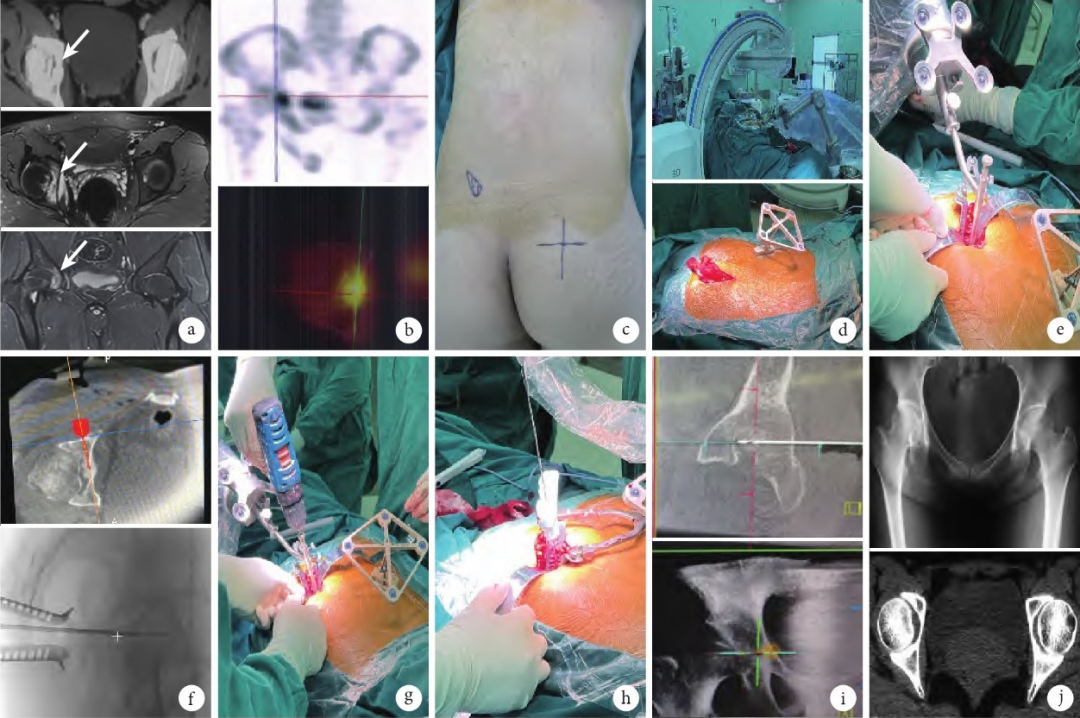
图3显示骨科机器人手术中对于骨盆髋臼肿瘤精准定位及微创治疗具有优势[11]
3、术后预防性抗生素治疗方案
肿瘤手术中的预防性抗生素方案(ProphylacticAntibioticRegimensinTumorSurgery,PARITY)试验是一项多中心、随机双盲对照研究,旨在确定1天与5天术后预防性抗生素治疗方案对肿瘤手术中手术部位感染(SSI)发生率的影响,且所有数据集于2022年1月在网上向所有研究人员开放。我们通过筛选最终纳入10篇关于骨与软组织肿瘤外科治疗相关的PARITY二次分析文献,这些研究主要聚焦于:SSI和下肢假体重建后再手术的风险因素、术后儿童患者与成人患者的功能结果、负压伤口治疗和术后引流的使用和手术部位感染的风险、下肢假体重建后血栓栓塞的风险、以及活检类型及其对手术变量和结果的影响等。

所有相关研究中普遍认为手术持续时间是许多临床结果的重要影响因素之一。Kal[13]评估了接受肿瘤切除和假体重建的患者早期再次手术的危险因素。结果显示与1年内再手术相关变量包括肿瘤类型、手术时间以及使用负压伤口引流,其中以手术时间显著性最高。Giglio[14]同样发现手术持续时间长短是再次手术的独立预测因子;研究还表明,良性骨肿瘤或骨转移瘤患者的再次手术风险较低;接受骨水泥固定的患者在术后1年表现出具有临床意义的功能改善,但是否使用骨水泥固定对术后1年再手术率没有影响,因此需要进一步随访调查长期存活率。除了会导致再次手术以外,Zeitlinger[15]研究发现手术持续时间是SSI的独立危险因素。然而手术持续时间受多因素影响,如术中皮瓣覆盖可延长手术时间,但会降低SSI风险。此外,研究认为延长术后抗生素治疗并不能降低感染风险。
Ray[16]分析显示与SSI治疗结果相关的单变量包括:较大范围软组织缺损,使用局部皮瓣/肌皮瓣覆盖,以及术中使用深部引流。在多变量模型中,原发性肿瘤切除期间的较大范围软组织缺损是唯一显著相关变量。Slawaska-Eng[17]研究显示术后1年内SSI相关的单变量包括:术前诊断、手术时间、肌肉切除量和住院时间(LOS);而在多变量分析中,住院时间是唯一的独立危险因素。因此,临床医生考虑简化骨肿瘤患者的出院计划可能是合理的,以潜在地降低SSI的风险。LiBrizzi[18]发现,术后引流持续时间≥14天,手术时间≥8h是SSI的独立预测因素。而术后使用引流管和负压伤口治疗都不是SSI预测指标。
综合上述研究结果,手术持续时间是SSI最显著相关的危险因素,较大软组织缺损、术后引流持续时间以及住院时间也会影响SSI的治疗结果。
4、骨缺损重建
四肢骨骼是良、恶性骨肿瘤的常见部位,恶性骨肿瘤切除后造成的大范围缺损会显著影响肢体功能以及生活质量。因此,在进行肿瘤切除的同时,重建肢体功能成为临床治疗的关键。为了恢复患者的生活质量和功能,研究人员一直在探索各种生物重建技术以及假体植入物机械重建,以重建大范围骨缺损,使患者能够恢复正常的步态和功能。骨缺损的重建也是目前骨与软组织肿瘤领域内的研究热点。
生物重建
Liu[19]和Jamshidi[20]研究显示同种异体骨移植可以较好重建恶性骨肿瘤切除术后骨缺损。对移植骨全长进行强有力的内固定保护是移植物长期存活的重要前提,而多维截骨增大接触面、髓内骨水泥加固等也可有效提高移植物存活率和愈合率。Zhang[21]认为在近端股骨置换术中,用合成韧带重建髋关节可改善软组织功能重建结果,减少术后髋关节脱位和假体感染发生率。Takeuchi[22]进行了一项多中心的回顾性队列研究,结果显示冷冻、照射和巴氏灭菌的自体瘤段骨回植术并发症发生率(5年时42%,10年时51%,骨不连和感染最多)、移植成活率(5年时87%,10年时81%),与异体骨移植的研究结果相当。因此当获得异体骨困难或患者由于成本或社会宗教等原因不愿接受肿瘤假体和异体骨移植时,可考虑经灭活处理的自体瘤段骨回植。
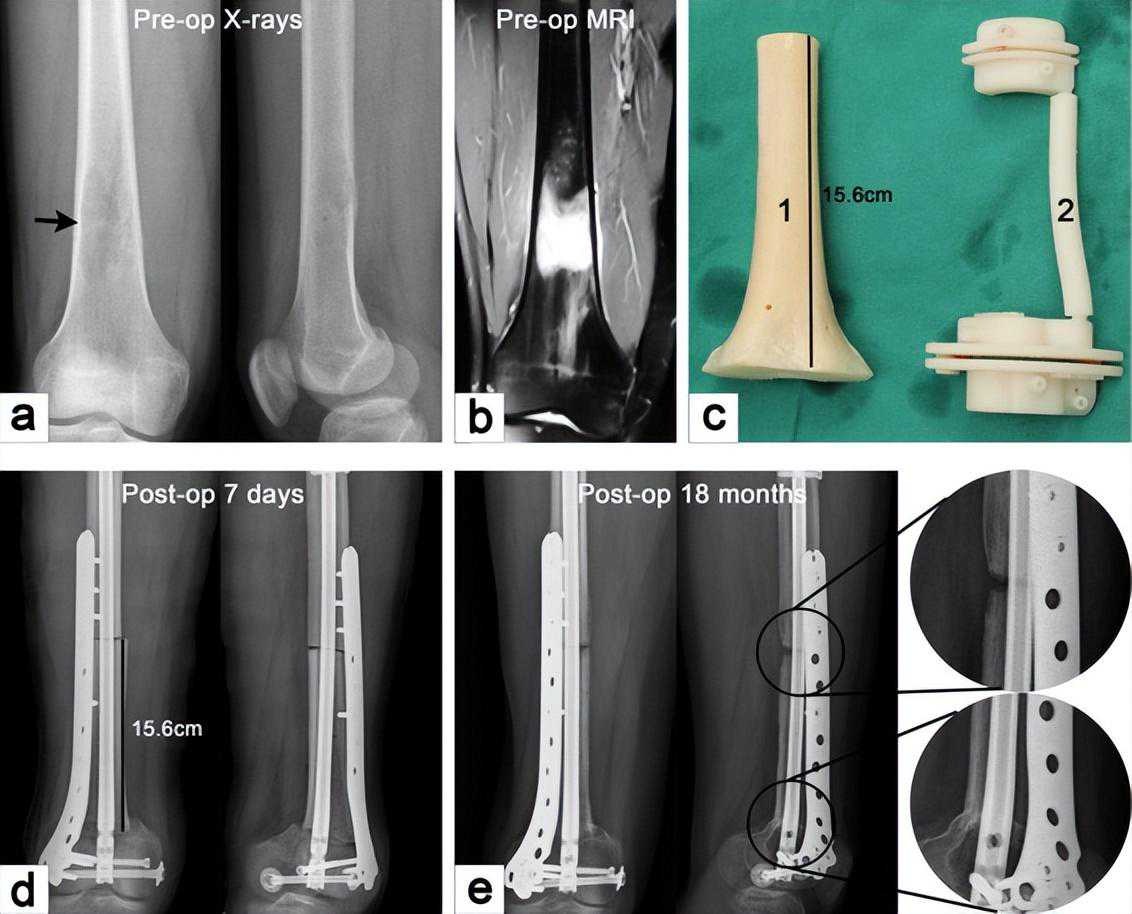
图4异体骨移植联合3D打印截骨导板重建股骨远端大段骨缺损[19]
带血管蒂腓骨移植(VFG)是目前肢体功能恢复较好、并发症发生率较低的骨重建技术,相关报道也较多。Xu[23]认为VFG中传统被舍弃的自体半月板和交叉韧带可作为补充组织瓣回收,以修复膝关节周围重建后的软组织缺损。Dai[24]研究显示液氮灭活结合VFG重建对儿童膝关节周围骨肉瘤进行自体骨移植和骨骺保护是安全有效的,术后愈合率、肢体长度和功能均较好。Kim[25]认为在肿瘤切除术后使用单侧VFG、内侧锁定板和同侧胫骨进行三柱重建治疗可以有效重建大段胫骨缺损,且在胫骨代偿性增粗和骨愈合前患者就可以实现早期负重。
Campanacci[26]发表了肱骨肿瘤切除术后VFG的长期随访结果,Revision-freesurvival(无翻修生存率)5年71%,10年及15年均为57%,Removal-freesurvival(复合移植物生存率)5年10年及15年均为94%;此外,通过使用长跨度板固定,可减少术后前5年内机械并发症发生率。Mericli[27]通过比较不同的置入方法(包括外置、髓内和间置)下的骨愈合率,认为VFG是所有四肢长骨缺损功能重建的可靠选择,但常伴并发症。在即刻进行股骨重建患者中,相较于外置方法,髓内腓骨放置并发症发生率较低,并更快实现早期骨愈合。
Lesensky[28]比较了VFG与单纯同种异体骨移植重建的结果。基于有活力的腓骨可增强同种异体骨的结合,并降低结构失效和感染并发症的风险,作者使用连续CT扫描评估腓骨活力和重建结果。结果显示单纯同种异体移植组发生不愈合和感染并发症的风险较高,但不具备统计学差异;而VFG成功率为70%(3例移植失败),且分析结果认为骨发育成熟或发育水平较高的患者失败风险增加。
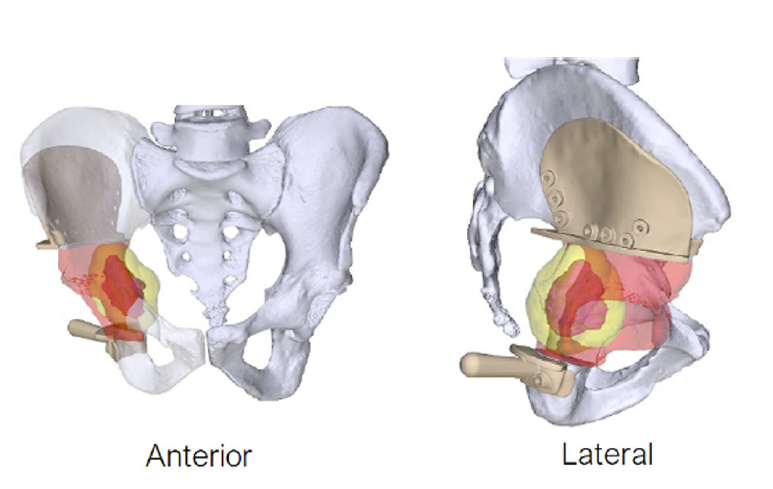
图5VFG重建影像学结果[26]
机械重建
对于机械重建,目前主要报道了假体失败和翻修的影响因素以及长期随访结果中的假体存活率。Geiger[29]报告了267名初次或翻修的水泥型股骨远端假体的预后结果,发现股骨远端翻修水泥假体相比初次手术更容易出现假体失败,主要的原因是假体骨折(37%)与无菌性松动(15%)。进一步的分析指出15mm的假体柄直径是所有原因翻修的独立风险因素(OR=4),因此提出要尽量植入更大尺寸假体柄,并使用抗扭转设计(如定制横向螺钉)来降低无菌松动发生率。Arnold[30]利用假体数据库研究术前或术后放射治疗与各类骨与软组织肿瘤假体置换失败率之间的关联,结果显示接受高剂量放射疗法(总剂量3000Gy)的患者与低剂量或未接受放射疗法的患者相比,平均假体失败率更高、有效时间更短,表明了高剂量放射对假体置换的影响。
Johnson[31]评估了肱骨和股骨骨干假体重建的生存率,1年和5年假体翻修的累积发生率分别为11%和16%,认为在该患者群体中假体生存率较好。Rizkallah[32]发现进行股骨近端假体置换且保留大转子的患者与进行肌腱附着点重建的患者在功能上前者的脱位率较低。Sadek[33]随访调查发现使用组配式假体重建的股骨远端骨肉瘤患者结果较好,5年假体生存比例超过2/3,10年假体生存比例超过一半。Ebeid[34]认为组配式假体重建胫骨近端骨肉瘤切除患者肢体功能是可靠的治疗选择,且大部分并发症可控。

3D打印假体也是目前机械重建领域的研究热点。Zheng[35]利用3D打印技术设计了个性化、解剖学匹配、抗生素骨水泥占位器模具,用于治疗骨肿瘤手术后的骨缺损感染问题,短期结果良好。Li[36]通过计算机辅助设计和3D打印个性化髓针钢板复合固定假体精确翻修了出现无菌性松动甚至导致严重骨质溶解的假体置换患者。Hu[37]通过文献综述提出目前3D打印技术定制骨盆假体虽然存在价格昂贵、耗时,但这项技术具有显著改善假体融合、长期稳定性和适型匹配的优势,具有很好地应用前景。
骨盆假体重建结果在目前也有文献报道。Rizkallah[38]报道了加拿大5个骨科中心使用LUMiC假体进行骨盆重建的中期结果,显示假体无菌松动发生率低,脱位和感染是最常见的并发症。Hinckley[39]回顾性地研究了接受3D打印髂骨假体重建的患者,结果显示2年随访期内患者存活率92%,且假体可提供坚强的短期固定。
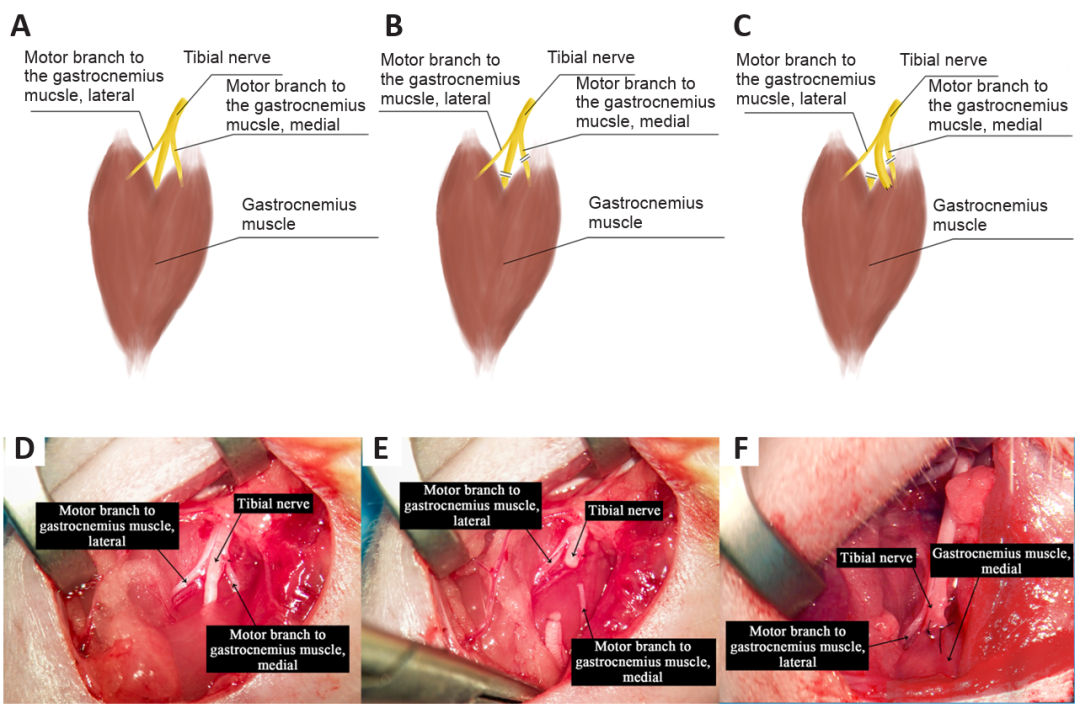
图6髋臼周围软骨肉瘤3D打印髂骨假体重建示意图[39]
对于假体植入材料、结构设计和固定方式的改进也在探索中。Bhashyam[40]研究显示对于大段骨切除且使用小量残存骨和大块骨水泥填充的肱骨干骨肿瘤,远端由于应力作用易发生失败。因此建议植入较大直径的碳纤维增强聚醚醚酮(CFR-PEEK)髓内钉(IMN),且植入期间使用间置同种异体骨代替骨水泥间隔填充物,并在远端附加钛板增加强度。Tanaka[41]对36位股骨远端恶性骨肿瘤患儿,进行了CompressCompliantPre-Stress(CPS)主轴骨整合假体与OrthopedicSalvageSystem(OSS)可延长装置结合的置换,结果显示CPS的骨整合率与稳定性高(94.3%),但可延长装置的失败率较高(22%)。总体实现了更高的保肢率(91%),提示可延长假体可作实现儿童骨成熟前有效的机械重建。
综合上述文献,对于生物重建和假体重建,回顾性队列研究仍然是评估疗效的普遍研究方法,结合假体结构优化以及移植物改善,目前已经可以满足大部分骨肿瘤患者的生存与生活需求。未来研究聚焦于儿童可延长假体、新型假体材料等方面。
5、其他外科治疗选择
虽然保肢手术是目前的主要治疗方法,但对于不具备保肢条件的恶性骨肿瘤患者,截肢仍然是不可或缺的治疗选择。Geiger[42]研究发现对于下肢骨肉瘤患儿,初次截肢和复发后截肢都会明显降低生活质量,且后者风险更大。Huynh[43]认为,旋转成形术、骨融合、靶向肌肉神经分布重建(TMR)和再生性外周神经接口(RPNI)可提供比传统截肢更好的功能恢复效果。
Ramsey[44]报道了11例使用旋转成形术治疗肿瘤假体重建后发生慢性感染的病例。表明这种手术可以重建一定肢体功能,并且是一种替换高位大腿截肢或髋关节离断的方案。Kapoor[45]认为尺骨中心化与尺腕关节融合术是一种简单有效的桡骨远端肿瘤切除后重建方式,且治疗后握力良好、并发症少。目前,旋转成形术和关节融合已经被证明具有临床应用价值。
而TMR和RPNI作为前沿技术产物也将逐渐应用于骨与软组织肿瘤领域。大脑发出的肢体运动意图(LMI)经过大脑-脊髓-外周神经-骨骼肌通路进行传导,而截肢患者的传导通路在外周神经这一环节中断。TMR手术将离断的外周神经转位至残端或躯干的肌肉组织,以重建截肢后中断的信号传导通路[46]。目前已有小系列病例报告显示TMR可有效减少上下肢截肢后的相关疼痛。RPNI是一种神经接口技术,由已被切割并被植入肌性移植物中的外周神经组成,且已经在动物模型上成功实现[47]。

图7左后肢TNT和TMR大鼠模型。(A)正常组、(B)TNT组和(C)TMR组;(D)显露胫神经及其分支,(E)切断胫神经和腓肠肌内侧头的运动分支,(F)将被切断的胫神经近端缝合到腓肠肌内侧。TMR:靶向肌肉重神经,TNT:胫神经切断。[48]
此外,Karda[49]研究发现按摩疗法会显著增加骨肉瘤患者乳酸脱氢酶(LDH)和碱性磷酸酶(ALP)水平,增加截肢和转移风险、降低生存率。在既往接受过按摩治疗的患者中,转移的发生速度快三倍。因此,严禁对骨肉瘤患者进行按摩治疗。
二、各瘤种及亚型外科治疗进展骨肿瘤类型繁多,以骨肉瘤、软骨肉瘤、尤文肉瘤为最常见的三种原发恶性骨肿瘤;而软组织肉瘤则病理类型复杂,亚型有50余种。因此对于不同瘤种和亚型都有不同的治疗方案和手术技术,也是目前的研究热点。
1、原发性骨肿瘤
骨肉瘤是最常见的原发恶性骨肿瘤,约20%患者为转移性骨肉瘤,孤立性肺转移患者5年无事件生存率(EFS)40%;多发性肺转移或其他部位放射学可检测到的转移性疾病的患者,5年EFS20%[50]。Kuo[51]纳入61例在初次治疗期间或首次复发时接受骨肉瘤肺转移切除术(PM)患者评估了包括开胸手术、胸腔镜手术、胸腔镜联合开胸手术(胸腔镜为首选方法,后续转为开胸手术)在内的手术方式对患者生存率的影响。结果显示,在初次治疗中,所有技术的气胸发生率相当,但在首次复发行PM时,胸腔镜手术组的发生率显著降低。开胸手术组和胸腔镜联合开胸手术组在初次治疗和首次复发治疗中疼痛更严重,作者推测可能是由于反复开胸或先前瘢痕形成引起的广泛组织损伤导致神经性疼痛增加。
尽管三种方法在患者生存率上并无差异,但在确保病灶完全清除的前提下胸腔镜手术的并发症发生率更低。Mettmann[52]认为对于骨肉瘤首次复发时的孤立性肺转移患者,完全手术切除病灶可显著提高长期生存率。上述研究中纳入的患者生存率都较低,因此目前对于骨肉瘤肺转移患者仍需要创新疗法。
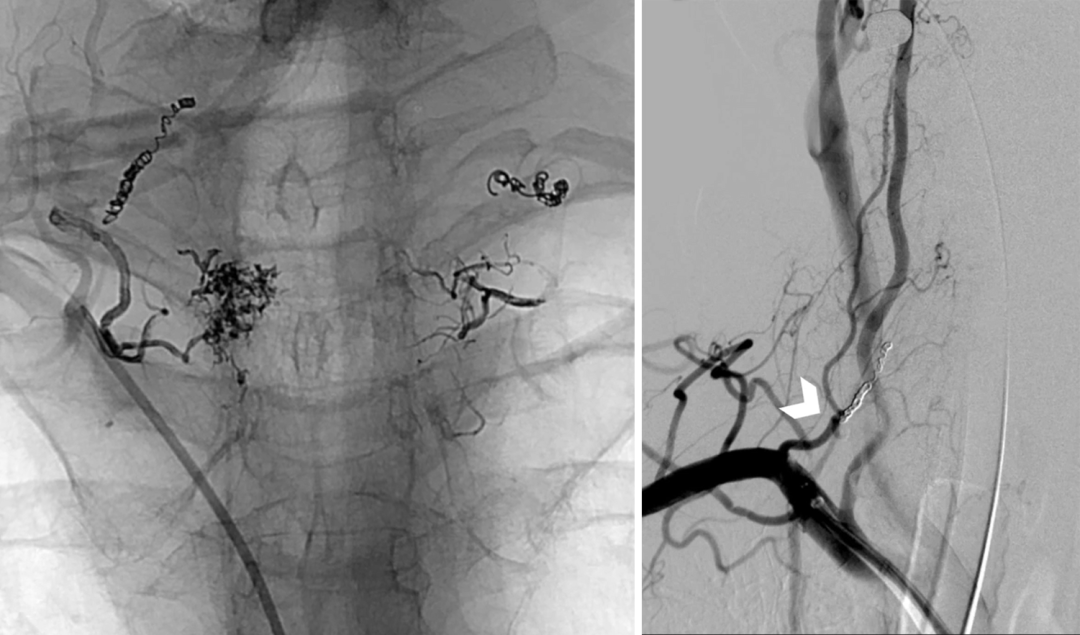
图8行PM的骨肉瘤患者生存曲线[51]
对于良性骨肿瘤的外科手术需要慎重选择。Döring[53]纳入119名单房性骨囊肿(UBC)患者,研究发现儿童UBC患者更可能出现开放性手术治疗失败,研究者认为UBC的开放性手术适应症为病理性骨折风险高、伴广泛骨质溶解、生长活跃及影像学诊断困难需要组织活检的患者。Ismail[54]纳入88名原发性良性骨肿瘤患者,认为对于良性骨肿瘤刮除术后是否填充空腔仍存在争议。
骨巨细胞瘤(giantcelltumor,GCT)是一种原发交界性骨肿瘤,常通过病灶刮除填充手术和肿瘤骨切除重建术治疗,然而GCT常因肿瘤残留术后复发。尽管有研究认为[55]CT引导下射频消融治疗复发性GCT在术后初期展现出较好的治疗效果,但随访时间较短、病例数较少,目前针对骨巨细胞瘤的文献更多聚焦于复发性GCT的治疗选择及比较。Aoude[56]回顾性分析了接受保留关节手术(刮除植骨或整块切除)的GCT局部复发的风险因素。研究发现与切除相比,刮除术的局部复发率较高。年龄较小(<30岁)和发病部位在桡骨远端是局部复发的高危因素。再次手术可有效治疗复发性GCT。
Koucheki[57]对13项研究包括373名患者进行系统评价,同样显示在桡骨远端GCT手术治疗中,与整块切除重建相比,刮除术会增加局部复发风险,但会显著减少并发症、降低疼痛评分,并改善功能结果。Ebeid[58]对膝关节周围GCT患者进行回顾性评价,认为刮除术结合骨水泥填充初次治疗效果较好,但会出现不同程度的膝关节骨性关节炎。Leng[59]研究显示应尽可能对脊柱复发性GCT患者实施扩大边界的全脊椎切除术(TES),有助于长期的局部控制和症状缓解。Pitsilos[60]随机对照试验结果显示GCT患者刮除术(IC)比整块切除术(EBR)的二次复发率更高。在IC组中,使用骨水泥填充而非骨移植术时,二次复发率较低,功能结果较好。在EBR组中,使用异体骨移植物重建骨缺损比使用假体结果更好。因此研究认为EBR或IC联合骨水泥是复发性GCT的最佳治疗选择。
Muratori[62]回顾分析接受病灶内刮除术治疗的69例软骨母细胞瘤(CBL)和接受切除术治疗的6例CBL,认为超过90%的CBL可通过扩大刮除术治疗。在极少病例中,长期随访有骺板损伤和关节炎的发生。而对于其他亚型的软骨肿瘤,如长骨非典型性软骨源性肿瘤(ACT)也有新的治疗策略出现。Scholte[63]研究发现,由于惰性临床行为,ACT治疗方式正在从病灶切除/刮除术转向定期影像学随访(首选MRI)进行监测。

骨样骨瘤是由骨母细胞及其所产生的骨样组织形成的良性肿瘤,约占良性骨肿瘤的1.66%~10%。目前普遍认为CT引导下微创切除术和经皮射频消融术基本可以完全治愈骨样骨瘤,且中期随访显示结果良好。Atiç[64]认为CT引导下手术切除术和射频消融术均有较高的成功率,但射频消融术可更快恢复日常活动,而无需活动限制或支具保护。Balbaa[65]同样评估了CT引导下经皮射频消融术(PRFA)治疗儿童关节内骨样骨瘤的安全性和有效性。研究发现整个随访期间100%患者症状缓解、临床治疗成功,且随访期间未发生疼痛持续、复发以及不良反应。除了常见的四肢骨样骨瘤外,Liu[66]采用计算机辅助导航全可视化脊柱内窥镜治疗腰椎骨样骨瘤,通过计算机规划路径和术中可视化内窥镜,成功切除L3椎体后缘的肿瘤,最大限度减少了对脊柱稳定性的损害。
骨盆也是骨肿瘤的好发部位之一,然而由于骨盆手术的位置特殊、手术难度大,2023相关文献报道较少。Zhang[67]对髋臼周围骨肉瘤接受骨盆半切除术后髋移位的患者进行了多中心回顾,大多数患者在术后2个月内能够重新获得步行功能,并提出髋移位是骨盆假体重建的可行替代方案。
脊柱也是骨肿瘤原发重要部位之一,前文述目前治疗理念转向分离手术联合立体定向放疗综合控制,但相关研究对象多为脊柱转移瘤患者。对于脊柱原发肿瘤目前仍将全脊椎切除术(TES)、椎板切除术等外科手段作为基本治疗手段。Kolz[70]回顾了31例手术治疗脊柱脊索瘤复发的患者,发现复发后5年总存活率仅为39%。再次手术对于病人总生存率无影响,但对于无远处转移的患者再次手术切可以改善生存率,切缘阴性的整块(enbloc)切除可以显著提高总生存时间,阳性切缘是再次复发的风险因素(OR=7.92),外科切除有助于预防神经功能障碍。
Yang[71]使用自制改良的椎间钩刀进行TES能够有效缩短手术时间和术中出血量,同时确保神经功能和疼痛症状的改善。Rong[72]则应用改进的超声骨刀行胸腰段肿瘤的椎板切除术,采用骨对骨保留韧带(Bone-to-boneLigamentPreserving,BLP)椎板成形术,保留后纵韧带复合体。结果发现BLP椎板成形术不会增加硬膜、脊髓或神经损伤的风险,认为该技术对于胸腰段脊柱肿瘤切除,创伤较小且速度更快,可稳定修复脊柱。Bonnet[73]认为在脊髓或神经根受压明显的情况下,酒精栓塞和椎体切除术可有效治疗椎体血管瘤,并能对神经症状产生长期获益。栓塞前的安全规范包括术前脊髓血管化图谱和通过术前造影评估肿瘤内无危险的血管吻合。

图9右侧肋间动脉栓塞(采用高强度聚乙烯醇行远端栓塞、可拆卸线圈行近端栓塞)[73]
2、骨转移瘤
骨转移瘤(metastaticbonecancer)是指原发于某器官或组织的恶性肿瘤的癌细胞通过血液循环等途径经过游走、扩散、种植到某些部位的骨组织上所形成的继发性肿瘤。纳入文献中主要针对脊柱转移瘤。
脊柱转移瘤好发部位为腰椎、胸椎及骶椎,尤以腰椎多见,这主要与腰骶丰富的静脉丛有关。对于转移瘤患者实施TES手术需要慎重考虑,Vargas[74]比较了在没有脊髓压迫的情况下,手术是否比放疗更有效。研究显示接受手术的脊柱肿瘤不稳定性评分(SINS)值为7-12的脊柱转移瘤患者在Karnofsky体能状态(KPS)评分上比仅接受放疗的患者有更大的改善,但在东部肿瘤合作组(ECOG)评分上没有改善。此外,研究建议放疗过程中出现骨折的患者应转为手术等介入性治疗。然而,Yamada[75]研究显示TES和术前不可行走状态是影响脊柱转移瘤手术后行走状态不良的重要因素。因此对TES手术实施的术前评估是尤为重要的。

相较于传统手术治疗,目前放疗联合手术在椎体转移瘤中应用较多,新型治疗方式不仅可以提高肿瘤局部控制率,还能有效保护脊髓。目前,脊柱转移瘤行立体定向放疗(SRBT)最好的剂量分割方式尚无统一定论,Wong[76]报道了49例脊柱转移瘤患者(共61个转移病灶)接受照射剂量为10~16Gy的单次放疗。结果显示疼痛缓解的中位时间为14天、缓解率85%、复发率仅7%;随访结果显示1年生存率74.3%,且2年随访期间无脊髓损伤发生。Zeng[77]分析SBRT治疗脊柱转移瘤患者,并将剂量增加至28Gy、每日2次,结果显示局部控制改善,且不增加椎体压缩性骨折(VCF)风险。除立体定向放疗外,研究显示手术联合放射性125I粒子植入能更好控制肿瘤生长,延缓或阻止肿瘤侵犯脊髓,保护脊髓神经功能完整。有研究[78]回顾性分析了行放射性125I粒子植入联合经皮椎体成形术(percutaneousvertebroplasty,PVP)治疗累及硬膜囊的脊椎转移瘤患者,20例患者手术均成功,术后1、3、6个月肿瘤控制有效率分别为70.0%、70.0%和88.9%。
对于手术方式和入路的优化也有新的进展。Cui[79]认为经小切口和经微创通道(TheTrans-TubularApproach)进行减压手术对椎体转移瘤患者都是安全和有效的;而对于血供不足的肿瘤患者,应选择经管道途径。此外,Huang[80]提出脊柱转移瘤术前栓塞(PE)是在手术过程中减少术中出血的有效手段。Damante[81]同样认为转移瘤患者中,PE与改善局部控制(LC)和疼痛控制有关。
脊柱转移瘤包括多瘤种亚型。Tong[82]强调了局部手术在乳腺癌骨转移患者中的重要性,并提出一种基于T分期、肝脑转移和乳腺亚型等因素预测患者是否受益于手术的模型。Zhai[83]提出细胞灭活根治性前列腺切除术(cRP)可能会提高低前列腺特异性抗原(PSA)且未接受化疗的骨转移年轻患者总生存期(OS)和癌症特异性生存期(CSS)。此外,在接受cRP患者中观察到实施淋巴结清扫术(LND)的患者有明显OS或CSS提升,尤其是扩大范围的LND。Ladegaard[84]研究发现与多发性骨转移患者相比,手术治疗孤立性骨转移患者可显著提高生存率。
3、软组织肉瘤
尽管近年来对于软组织肉瘤的文献报道多聚焦于放疗和新辅助治疗,但Rothermundt[85]明确指出,手术治疗仍然是软组织肉瘤的标准治疗方法,但需避免在未行充分术前影像学检查、病理活检或缺乏切除边界评估等情况下行手术切除,即非计划手术(unplannedexcision)。Ryu[86]研究了开始治疗时间对软组织肉瘤患者预后的影响,发现诊断到手术之间的时间间隔越长,预后越差。
对于STS患者的手术管理也在不断的发展和细化。Sparber-Sauer[87]针对儿童非横纹肌肉瘤软组织肉瘤(NRSTS)做出专家共识,提出NRSTS阴性切缘为5mm,且荧光引导和超声等术中可视化技术有助于实现手术切缘阴性。Novak[88]比较了大腿内收肌群软组织肉瘤切除后采用皮瓣重建(FlapReconstruction,FR)与一期缝合(PrimaryClosure,PrC)患者的伤口并发症、肿瘤学及功能结果,显示尽管FR延长了住院时间,但对于较大肿瘤可有效减少伤口愈合并发症。在所有大小的肿瘤中,FR显示出与PrC相似的功能性和肿瘤学结果。基于这些发现,研究者认为对于≥15cm或体积≥800ml的肿瘤行皮瓣重建(FR)更易实现无并发症的伤口愈合。
此外,放疗等其他治疗方法同样可以作为手术治疗的有效辅助手段。Mayo[89]研究认为,术前短期大剂量放疗后7天内立即手术切除可显著缩短疗程,结果显示22例STS患者局部控制率100%,9名发生伤口并发症且其中8名需要二期手术治疗。研究者认为该治疗方案早期局部控制良好,但伤口并发症需要警惕。
对于罕见软组织肿瘤患者,不断创新手术方式以及综合多模式治疗以实现个性化治疗是未来的研究方向。Houdek[90]评估了骨外尤文氏肉瘤患者的治疗结果,并报道与仅接受外科手术的患者相比,接受包括手术、化疗和放疗在内的多模式治疗的患者的总生存期和无进展生存期均有所提高。Rust[91]报道广泛切除和安全切缘是隆突性皮肤纤维肉瘤的有效治疗方法,复发率低和长期预后良好。该研究还发现莫氏显微手术(Mohsmicrographicsurgery)是隆突性皮肤纤维肉瘤的潜在治疗选择。
三、总结骨与软组织肿瘤外科治疗的优势在于直接切除肿瘤,减少肿瘤负荷,提高患者生存率和生活质量。未来发展方向包括优化手术技术,提高精准性和完整性,探索新的治疗手段和药物,提供更多治疗选择和更佳治疗效果。同时,对于骨与软组织肿瘤的基础研究也需要不断深入,更好地理解肿瘤的发病机制及进展过程,为治疗提供更多思路和决策。
在现有的高质量文献中,骨与软组织肿瘤的外科治疗主要侧重于回顾性队列研究。在这些研究中,骨缺损的生物和机械重建技术成为了研究的热点。同时,术后抗生素的使用也展现出了新的研究潜力。然而,治疗的难点主要集中在骨盆肿瘤的切除重建、并发症管理以及骨肉瘤肺转移患者的创新疗法上。
考虑到骨与软组织肿瘤的种类繁多,且生物学行为复杂多变,因此,严谨的术前评估和规划、精确的术中操作以及完备的术后管理显得尤为重要。这些过程不仅需要遵循标准化和规范化的原则,还需要根据患者的具体情况进行个体化的调整。
综上所述,骨与软组织肿瘤的外科治疗是一个不容忽视的领域,需要我们不断地进行探索和创新,以提供更加优质的治疗效果和医疗服务。
参考文献[1]SiegelRL,GiaquintoAN,,2024[J].CACancerJClin,2024,74(1):12-49.
[2]DieffenbachBV,MurphyAJ,LiuQ,,majorsurgicalinterventioninsurvivorsofchildhoodcancer:areportfromtheChildhoodCancerSurvivorStudy(CCSS)cohort[J].LancetOncol,2023,24(6):691-700.
[3]ZarghooniK,BratkeG,LandgrafP,'sSarcomainChildrenandAdolescents[J].DtschArzteblInt,2023,120(24):405-12.
[4]ParkSJ,ParkJS,LeeCS,rMetastaticSpinalTumors:25-YearExperienceinaSingleInstitution[J].ClinOrthopSurg,2023,15(1):109-17.
[5]GuckenbergerM,AndratschkeN,BelkaC,:Stereotacticbodyradiotherapyforspinemetastases[J].RadiotherOncol,2023:109966.
[6]LeeSH,KimW,3D-printed,patient-specificresectionguidesforbonetumourresections?[J].BoneJointJ,2023,105-b(2):190-7.
[7]GonzalezMR,BediA,KarczewskiD,orseSurvivalOutcomes?ASystematicReviewandMeta-analysis[J].ClinOrthopRelatRes,2023,481(12):2433-43.
[8]BroidaSE,SullivanMH,BarlowJD,softhescapula[J].BoneJointJ,2023,105-b(12):1314-20.
[9]HersonER,HebertKA,WerthPM,idedsurgicalnavigation[J].JSurgOncol,2023,127(3):490-500.
[10]WangH,JiT,QuH,ngsurgeryforboneandsoft-tissuetumours[J].BoneJointJ,2023,105-b(5):551-8.
[11]李卓宇,刘巍峰,邓志平,等.骨科机器人辅助骨样骨瘤切除的早期疗效研究[J].中国修复重建外科杂志,2023,37:1319-25.
[12]冯均伟,梁伟民,王跃,等.骨科机器人辅助微创手术与开放手术治疗肢体骨样骨瘤的比较研究[J].中国修复重建外科杂志,2024,38:40-5.
[13]KalJK,Slawaska-EngD,GazamA,ndoprostheticReconstruction:ASecondaryAnalysisfromthePARITYTrial[J].JBoneJointSurgAm,2023,105(Suppl1):4-9.
[14]GiglioV,GazamA,SchneiderP,ostheticReconstructionSurgery[J].JBoneJointSurgAm,2023,105(Suppl1):15-21.
[15]ZeitlingerL,WilsonM,RandallRL,urgicalSiteInfectionandMayNotBeMitigatedbyProlongedAntibiotics:ASecondaryAnalysisofthePARITYTrialofInfectionAfterLower-ExtremityoprostheticReconstructionforBoneTumors[J].JBoneJointSurgAm,2023,105(Suppl1):79-86.
[16]RayGS,WerthP,AlexanderJH,eTreatmentofCancer:EvaluationofPatient,Disease,andIndexSurgicalFactors[J].JBoneJointSurgAm,2023,105(Suppl1):87-96.
[17]Slawaska-EngD,GazamAM,KalJ,tremityOncologicaloprostheticReconstruction:ASecondaryAnalysisofthePARITYTrialData[J].JBoneJointSurgAm,2023,105(Suppl1):41-8.
[18]LiBrizziCL,SabharwalS,ForsbergJA,mpacttheDevelopmentofSurgicalSiteInfections?:APARITYTrialSecondaryAnalysis[J].JBoneJointSurgAm,2023,105(Suppl1):34-40.
[19]LiuQ,LongF,ZhangC,netumorbyallograft:asingle-centerretrospectivecohortstudy[J].WorldJSurgOncol,2023,21(1):234.
[20]JamshidiK,KarimiA,BabaeiZarchMA,arallograftinpediatricpatients:aretrospectivecohortstudy[J].JShoulderElbowSurg,2023,32(12):e608-e15.
[21]ZhangC,HeH,TongX,Tumor-RelatedProximalFemoralReplacements[J].JArthroplasty,2024,39(2):472-9.
[22]TakeuchiA,TsuchiyaH,SetsuN,,Function,andSurvivalofTumor-devitalizedAutograftsUsedinPatientsWithLimb-sparingSurgeryforBoneandSoftTissueTumors?AJapaneseMusculoskeletalOncologyGroupMulti-institutionalStudy[J].ClinOrthopRelatRes,2023,481(11):2110-24.
[23]XuY,LiY,FuY,reconstructionfollowingmalignantbonetumorresectionaroundtheknee[J].CancerMed,2023,12(7):8027-37.
[24]DaiZ,SunY,MaihemutiM,rcomaaroundthekneeinchildren:Aretrospectivecohortstudy[J].Medicine(Baltimore),2023,102(10):e33237.
[25]KimMB,KimKW,LeeSH,fortheRepairofLargeTibialDefectsafterTumorResection[J].ClinOrthopSurg,2023,15(6):1029-35.
[26]CampanacciDA,ScanferlaR,InnocentiM,IntercalaryResectionoftheHumerusforPrimaryBoneTumors?[J].ClinOrthopRelatRes,2023,481(11):2185-97.
[27]MericliAF,AsaadM,LewisVO,:FactorsInfluencingUnionandFunctionalOutcomes[J].PlastReconstrSurg,2023,151(4):885-96.
[28]LesenskyJ,BelzarenaAC,MasekM,oraldiaphysisreconstruction[J].JBoneOncol,2023,41:100488.
[29]GeigerEJ,ArnoldMT,HartCM,lFemoralReplacementsforLimbSalvageofPatientsWithSarcoma?[J].ClinOrthopRelatRes,2023,481(3):460-71.
[30]ArnoldMT,GeigerEJ,HartC,ticLooseninginPatientsWithaSarcomaoftheLowerExtremitiesReconstructedWithaCementedoprosthesis?[J].Clinicalorthopaedicsandrelatedresearch,2023,481(3):475-87.
[31]JohnsonJD,SatcherRL,FengL,theticReconstructionforDiaphysealBoneMetastasesoftheHumerusandFemur?[J].ClinOrthopRelatRes,2023,481(11):2200-10.
[32]RizkallahM,AranetaKT,AoudeA,fterTumorResection[J].JAmAcadOrthopSurg,2023,31(1):34-40.
[33]SadekWMS,EbeidWA,GhoneimyAE,sarcomaManagedbyLimbSalvageUsingModularoprosthesis[J].AnnSurgOncol,2023,30(8):5150-8.
[34]EbeidWA,dReconstructionbyModularoprosthesis[J].AnnSurgOncol,2023,30(3):1914-25.
[35]ZhengK,YuXC,XuM,ceholderMoldforBoneDefectRepairandReconstructionwithInfection:ACaseReport[J].OrthopSurg,2023,15(10):2724-9.
[36]LiZ,LuM,ZhangY,eforPrecisionRevisionoftheProximalHumerusoprostheticReplacement:ATechniqueNote[J].OrthopSurg,2023,15(11):3000-5.
[37]HuX,LuM,ZhangY,sthesesafterlimb-salvagesurgeryforpelvicsarcomas:currentlandscape[J].BrJSurg,2023,110(12):1712-22.
[38]RizkallahM,FergusonPC,BasileG,®oprosthesisforpelvicreconstruction:ACanadianexperience[J].JSurgOncol,2023,127(4):727-33.
[39]HinckleyNB,BeauchampCP,ChristopherZK,ctionafterhemipelvectomyandrevisionarthroplasty?Theevolutionofacustomilium"monoflange"[J].JSurgOncol,2023,127(3):480-9.
[40]BhashyamAR,YeungC,SodhiA,[J].JShoulderElbowSurg,2023,32(11):2286-95.
[41]TanakaKS,AndayaVR,ThorpeSW,®spindleandexpandabledistalfemuroprosthesisamongpediatricpatients:Amulti-institutionalstudy[J].Journalofsurgicaloncology,2023,127(1):148-58.
[42]GeigerEJ,LiuW,SrivastavaDK,orLowerExtremitySarcoma:AChildhoodCancerSurvivorStudyReport[J].ClinOrthopRelatRes,2023,481(3):526-38.
[43]HuynhTHN,KuruvillaDR,NesterMD,:ModernPerspectives,Outcomes,andAlternatives[J].CurrOncolRep,2023,25(12):1457-65.
[44]RamseyDC,FourmanMS,BernerEA,SalvageinPatientsWithChronicLowerExtremityInfection?[J].ClinOrthopRelatRes,2023,481(6):1196-205.
[45]KapoorL,BanjaraR,SahooB,ctionFollowingResectionofCampanacciGrade3GiantCellTumoroftheDistalRadius[J].JHandSurgAm,2024,49(1):63.
[46]郭耀,赵巍,黄剑平,等.智能假肢的人机接口构建技术——靶向肌肉神经功能重建[J].中国修复重建外科杂志,2023,37:1021-5.
[47]ChoY,JeongHH,ShinH,[J].AdvSci(Weinh),2023,10(35):e2303728.
[48]LuW,LiJP,JiangZD,atsfollowingtibialnervetransection[J].NeuralRegenRes,2022,17(8):1827-32.
[49]KardaI,WanIsmailWF,,doesitreallycorrelate:acombinationofprospectiveandretrospectivecohortstudy[J].SciRep,2023,13(1):18541.
[50]BeirdHC,BielackSS,FlanaganAM,[J].NatRevDisPrimers,2022,8(1):77.
[51]KuoC,MalvarJ,ChiYY,lmonarymetastasectomyinpediatric,adolescentandyoungadultpatientswithosteosarcoma[J].CancerMed,2023,12(20):20231-41.
[52]MettmannVL,BaumhoerD,BielackSS,:Presentation,treatment,andsurvivalof219patientsoftheCooperativeOsteosarcomaStudyGroup[J].CancerMed,2023,12(17):18219-34.
[53]DöringK,SturzGD,HobuschG,:Aretrospectivedataanalysis[J].WienKlinWochenschr,2023.
[54]IsmailTB,MahmoudMM,AhmedOE,tillcontroversial[J].MedJMalaysia,2023,78(2):163-70.
[55]ArrigoniF,ZoccaliC,EvangelistaL,one[J].CardiovascInterventRadiol,2023,46(4):508-11.
[56]AoudeA,NikomarovD,PereraJR,[J].BoneJointJ,2023,105-b(5):559-67.
[57]KouchekiR,GazamA,PereraJ,:asystematicreviewandmeta-analysis[J].EurJOrthopSurgTraumatol,2023,33(4):759-72.
[58]EbeidWA,BadrIT,MesregahMK,entationofgiantcelltumorofbonearoundtheknee:long-termfollow-up[J].JOrthopTraumatol,2023,24(1):11.
[59]LengA,YangM,SunH,ne[J].OrthopSurg,2024,16(1):78-85.
[60]PitsilosC,GivissisP,PapadopoulosP,:ASystematicReview[J].Cancers(Basel),2023,15(13).
[61]WangW,hondrosarcomaoftheExtremities[J].OrthopSurg,2023,15(12):3288-99.
[62]MuratoriF,ScanferlaR,RoselliG,:analysisoflocalcontrolandgrowthplate/articularcartilagerelatedcomplications[J].BMCMusculoskeletDisord,2023,24(1):139.
[63]ScholteCHJ,DorleijnDMJ,KrijvenaarDT,:analternativeforcurettageinatypicalcartilaginoustumoursofthelongbones[J].BoneJointJ,2024,106-b(1):86-92.
[64]AtiçR,AlemdarC,ElçiS,ionforOsteoidOsteoma[J].MedSciMonit,2023,29:e940292.
[65]BalbaaMF,SpinelliMS,ArrigoniF,steomainchildren:Isthereaconcernforcartilagedamage?[J].RadiolMed,2023,128(8):999-1006.
[66]LiuR,TianJ,YuanJ,geryforLumbarVertebralOsteoidOsteoma[J].OrthopSurg,2023,15(9):2464-70.
[67]ZhangL,IwataS,SaitoM,arTumorResection:AMulticenterStudy[J].ClinOrthopRelatRes,2023,481(12):2406-16.
[68]GonzalezMR,KarczewskiD,BediADS,rgery:ANationalSurgicalQualityImprovementProgramstudy[J].JSurgOncol,2023,128(2):367-74.
[69]BensaidS,ContejeanA,MorandP,on:Riskfactors,microbiology,andimpactofextedpostoperativeantibioticprophylaxis[J].JSurgOncol,2023,128(2):344-9.
[70]KolzJM,WellingsEP,HoudekMT,[J].TheJournaloftheAmericanAcademyofOrthopaedicSurgeons,2023,31(5):e278-e86.
[71]YangW,ZhangK,LvJ,BladeinSpinalTumors:ARetrospectiveStudy[J].OrthopSurg,2023,15(6):1599-606.
[72]RongH,LiS,ZhangR,meAssistanceforIntraspinalTumors:ATechnicalNoteandClinicalFollow-Up[J].OrthopSurg,2023,15(6):1549-55.
[73]BonnetB,ShotarE,PrematK,vertebralhemangiomawithpriorembolizationofdangerousarterialanastomoses[J].JNeurointervSurg,2023,15(7):728.
[74]VargasE,ShabaniS,MummaneniPV,patientswithoutspinalcordcompressionbutwithpotentiallyunstablespines(SINS7-12)?[J].JNeurosurgSpine,2023,39(2):287-94.
[75]YamadaK,YoshiiT,TobaM,alSurgeryforMetastaticSpinalTumor[J].Spine(PhilaPa1976),2023,48(20):1419-26.
[76]WongHCY,LeeSF,ChanAW,adiotherapyforspinalmetastases:Asystematicreviewandmeta-analysisofrandomizedcontrolledtrials[J].RadiotherOncol,2023,189:109914.
[77]ZengKL,AbugaribA,SolimanH,:28GyVersus24Gyin2DailyFractions[J].IntJRadiatOncolBiolPhys,2023,115(3):686-95.
[78]肖全平,魏乐群,牛焕章.经皮椎体成形术联合~(125)I粒子组织间置入术治疗伴后缘破坏的椎体转移瘤[J].介入放射学杂志,2023,32:866-70.
[79]CuiY,MiC,WangB,almetastasesunderwentdecompressionsurgery---aretrospectivecohortstudy[J].BMCCancer,2023,23(1):1226.
[80]HuangYC,TsuangFY,LeeCW,ryusingangiographicvascularityassessment[J].EurRadiol,2023,33(4):2638-46.
[81]DamanteMA,Jr.,GibbsD,DibsK,mprovedLocalControlinPatientsReceivingSurgicalDecompressionandStereotacticBodyRadiotherapy[J].Neurosurgery,2023,93(2):320-9.
[82]TongY,XuS,JiangL,oregionalsurgicaltreatmentinpatientswithbonemetastasesfrombreastcancer[J].Frontocrinol(Lausanne),2023,14:1266679.
[83]ZhaiT,MaJ,LiuY,ninbone-metastaticprostatecancer:Apopulation-basedstudy[J].CancerMed,2023,12(16):16697-706.
[84]LadegaardTH,SørensenMS,[J].BoneJointJ,2023,105-b(11):1206-15.
[85]RothermundtC,AndreouD,BlayJY,:RecommationsoftheConferenceonStateofScienceinSarcoma2022[J].EurJCancer,2023,180:158-79.
[86]RyuJH,RahmanJ,DeoS,as[J].JSurgOncol,2023,127(7):1174-86.
[87]Sparber-SauerM,FerrariA,SpuntSL,uesarcomas:ConsensusonsurgicalmargindefinitionharmonizationfromtheINternationalSoftTissueSaRcomaConsorTium(INSTRuCT)[J].CancerMed,2023,12(10):11719-30.
[88]NovakR,NevinJL,RowellPD,,Soft-TissueSarcomaResection[J].AnnSurgOncol,2023,30(6):3701-11.
[89]MayoZS,ParsaiS,AshaW,pyforsofttissuesarcomafollowedbyimmediatesurgicalresection[J].RadiotherOncol,2023,180:109439.
[90]HoudekMT,HeidenreichMJ,AhmedSK,[J].JSurgOncol,2023,128(1):105-10.
[91]RustDJ,KwintaBD,GeskinLJ,[J].JSurgOncol,2023,128(1):87-96.
作者简介刘巍峰
北京积水潭医院主任医师,教授,骨肿瘤科行政副主任(主持工作)、党支部书记。
国家骨科医学中心工作委员会;
国家重点研发计划首席科学家;
中华医学会骨科学分会青年委员会骨肿瘤学组副组长;
中国医药教育协会骨与软组织肿瘤专业青年委员会副主任委员;
中国初级保健基金会骨与软组织肿瘤专委会副主任委员;
CACA肉瘤专业委员会智能骨科与精准诊疗学组组长;
CACA骨肿瘤与骨转移瘤专业委员会数字骨肿瘤学组副组长;
CACA肉瘤专业委员会基础研究及转化学组副组长;
CACA骨肿瘤与骨转移癌专委会青年学组副组长;
CACA骨肿瘤与骨转移瘤专委会药物与精准治疗学组委员;
CSCO黑色素瘤专家委员会常务委员青委会副主委;
国家卫生健康委儿童恶性肿瘤(实体肿瘤)专家委员会委员。
孙扬
北京积水潭医院骨肿瘤科,医学博士。
中国抗癌协会肉瘤专业委员会智能骨科与精准诊疗学组委员;
中国抗癌协会肉瘤专业委员会化放疗学组委员;
中国抗癌协会骨肿瘤和骨转移瘤专业委员会青年学组委员;
主持北京市优秀人才培养资助项目1项,北京市创伤骨科研究所改革与发展专项1项。参与国家重点研发计划2项,国家自然科学基金2项,首都医学发展科研基金2项。
徐鸿锋
北京大学第四临床医学院,临床医学,预备党员。
曾获北京大学“挑战杯”三等奖、基础医学院创新人才项目三等奖、2023年暑期科研三等奖。
参与国家重点研发计划重点专项1项。
声明:此文内容及图片由供稿单位提供,仅供学习交流,不代表骨科在线观点。
很赞哦!(83)
上一篇:半个娱乐圈都跟牙齿较上劲了?
下一篇:牙齿痛







